Cách cân bằng phản ứng oxi hóa khử nhanh
Cách cân đối bội nghịch ứng oxi hóa khử nkhô giòn duy nhất chắc rằng luôn luôn là vấn đề mà các bạn học viên lưu lại vai trung phong duy nhất. Để cân bằng phản bội ứng không chỉ việc sự tỉ mỉ, tứ duy cơ mà đề xuất cả một số mẹo. Sau phía trên, topgamebanca.com xin chia sẻ phương pháp làm bài hiệu quả duy nhất.
Bạn đang xem: Cách cân bằng phản ứng oxi hóa khử nhanh
I. Nội dung phương pháp thăng bằng làm phản ứng thoái hóa khử
1. Cách cân đối phản nghịch ứng thoái hóa khử nkhô nóng nhất
Nội dung 1: Số oxi hoá, phương thức tính số thoái hóa của nguyên tố trong số phù hợp hóa học hóa học
Số thoái hóa của một ngulặng tố trong phân tử là số năng lượng điện của ngulặng tử đó vào công thức chất hóa học, tức hiểu rằng links thân những nguim tử nguyên tố trong phân tử là liên kết ion.Quy tắc khẳng định số oxi hóa của các chất:• Trong đối chọi chất, số oxi hóa nguyên tố là 0.• Tổng những số oxi hoá của các nguyên tử vào phương pháp phân tử (trung hoà điện) bởi 0.• Tổng các số oxi hoá của những nguyên tử nguyên ổn tố trong một ion phức tạp bởi năng lượng điện của ion đó.• khi tmê mẩn gia vào phân tử, số oxi hoá của 2 nguyên tố cơ phiên bản tất cả trị số không đổi: H là +1, O là -2 …Lưu ý: Dấu của số oxi hoá đặt trước con số, và vết của điện tích ion đặt sau số lượng (số thoái hóa Fe+3 ; Ion Fe (III) ghi: Fe3+. Đây là để ý đặc biệt trong cân đối làm phản ứng thoái hóa khử.
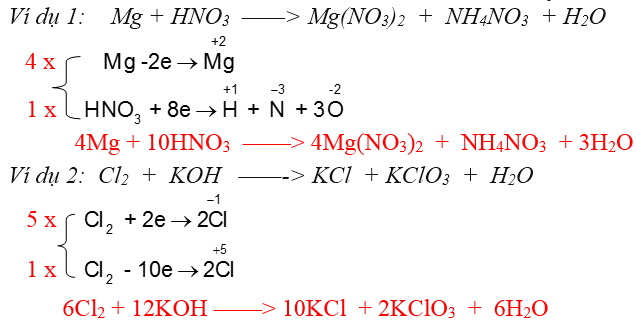
Nội dung 2: Các phương thức cân bằng bội phản ứng oxi hoá khử
Phương thơm pháp 1: Phương thơm pháp cân đối đại số 1-1 giảnNguim tắc Khi cân bằng:Số nguyên tử của mỗi ngulặng tố nằm ở nhị vế luôn bằng nhau.Quy trình cân bằng:Đặt ẩn số là các thông số thích hợp thức. Dùng định nguyên tắc bảo toàn khối lượng nhằm cân bằng ngulặng tố và lập phương trình đại số.Ví dụ: a FeS2 + b O2→ c Fe2O3 + d SO2Ta có: Fe : a = 2cS : 2a = dO : 2b = 3c + 2dChọn c = 1 thì a=2, d=4, b = 11/2Nhân toàn bộ nhì vế với 2 ta được phương thơm trình mới4FeS2 + 11O2 → 2Fe2O3 + 8SO2Phương thơm pháp 2: Sử dụng theo cách thức cân đối electronNguim tắc: phụ thuộc vào sự bảo toàn số electron nghĩa là toàn bô electron của chất khử cho luôn luôn luôn bằng toàn bô electron hóa học thoái hóa dìm.
Xem thêm: Hướng Dẫn Cách Làm Trắng Bạc Sau Khi Đánh Gió, Đã Làm Là Thành Công
 Các bước cân bằng cân bằng phản ứng oxi hoá khử
Các bước cân bằng cân bằng phản ứng oxi hoá khử

Bước 1: chấm dứt sơ đồ phản ứng với các nguim tố có sự cụ đổi số oxi hóa.Cách 2: Hoàn thiện nay các quá trình: khử (đến electron), oxi hóa (nhận electron).Bước 3:Cân bằng electron: nhân hệ số để:Tổng số electron đến = tổng số electron nhận.(tổng số oxi hóa giảm = tổng số oxi hóa tăng).Bước 4: Cân bằng nguim tố không thay đổi số oxi hoá :sắt kẽm kim loại (ion dương):cội axit (ion âm).môi trường (axit, bazơ).nước (cân nặng bằng H2O để cân bằng hiđro).Cách 5: Kiểm soát số ngulặng tử oxi ở 2 vế (phải bằng nhau).
Xem thêm: Cách Nấu Bún Cá Rô Đồng - Cách Nấu Bún Cá Rô Ngon & Chuẩn Nhất 2021
Ví dụ:Fe + H2SO4quánh lạnh → Fe2(SO4)3 + SO2 + H2OFe0 → Fe+3 + 3e1 x 2Fe0 → 2Fe+3 + 6e3 x S+6 + 2e → S+42sắt + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H20Phương thơm pháp số 3: phương thức cân đối phương thơm trình oxi hóa khử theo ion – electron:Đối tượng áp dụng: sử dụng trong các quá trình diễn ra trong các hỗn hợp, gồm sự xuất hiện của môi trường xung quanh (H2O, hỗn hợp axit, bazơ tđam mê gia).Các vẻ ngoài cơ bản áp dụng:•Trường phù hợp phản nghịch ứng bao gồm axit tmê mệt gia: mặt như thế nào của pmùi hương trình vượt O buộc phải thêm H+ nhằm tạo nên H2O và ngược trở lại.•Trường hợp làm phản ứng bao gồm bazơ tsay mê gia: mặt nào của phương thơm trình thừa O yêu cầu thêm H2O nhằm tạo nên OH-Các bước tiến hành:Bước 1: Tách các ion, tính số các nguyên tố có số oxi hóa cầm đổi tiếp đến viết các nửa phản ứng oxi hóa – khử.Bước 2: Cân bằng các bán phản ứng:Cân bằng số nguyên tử của nguyên ổn tố ở nhị vế vào phương trìnhThêm H+ hoặc OH-Thêm H2O để làm cho đảm bảo cân bằng số ngulặng tử HTính toán thù làm sao để cho số nguim tử oxi ở 2 vế buộc phải thăng bằng.Tiếp theo là cân bằng điện tích: thêm electron vào mỗi nửa phản ứng để cân nặng bằng điện tích trong phương thơm trìnhBước 3: Cân bằng electron: triển khai nhân hệ số để:Tổng số electron mang đến = tổng số electron nhận.(tổng số oxi hóa giảm = tổng số oxi hóa tăng).Cách 4: Cộng tổng các nửa phản ứng ta có phương thơm trình ion thu gọn.Cách 5: Để chuyển phương trình dạng ion thu gọn thành pmùi hương trình ion đầy đủ và phương trình phân tử cần cộng vào 2 vế những lượng bằng nhau các cation hoặc anion để bù trừ điện tích ta thăng bằng được phản ứng oxi hóa khử.
2. lấy ví dụ cầm thể
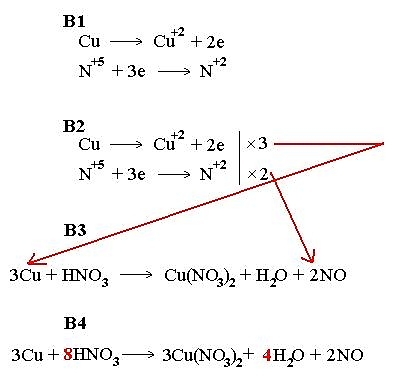
Ví dụ: Cân bằng phương thơm trình phản ứng:Cu + HNO3 → Cu(NO3)2 + NO + H2OBước 1: Cu + H+ + NO3- → Cu2+ + 2NO3- + NO + H2OCu0 → Cu2+NO3-→ NOBmong 2: Cân bằng nguim tố:Cu → Cu2+NO3- + 4H+ → NO + 2H2OCân bằng năng lượng điện tíchCu → Cu2+ + 2eNO3- + 4H+ + 3e → NO + 2H2OBước 3: Cân bằng electron:3 x Cu → Cu2+ + 22 x NO3- + 4H+ + 3e → NO + 2H2OBước 4: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO + 4H2OBước 5: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO +4H2O